Vanilloid versus Isovanilloid: IPB-Wissenschaftler entwickeln maßgeschneiderte Enzyme mit veränderter Regiospezifität.
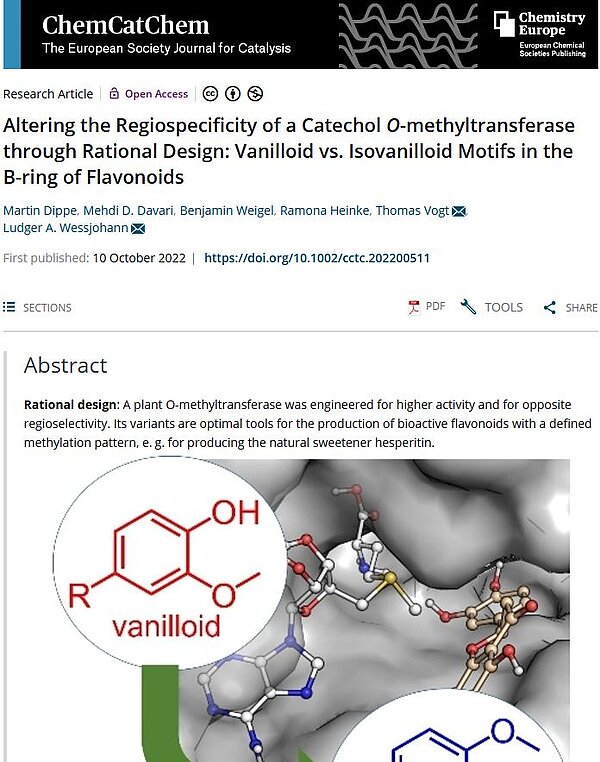
Obgleich die biokatalytische Herstellung von pflanzlichen und synthetischen Wirkstoffen im Reagenzglas zunehmend an Bedeutung gewinnt, birgt sie noch viel Potential zur Entwicklung und Verfeinerung. Die gezielte Produktion von gewünschten Substanzen oder Stoffgruppen ist zurzeit noch limitiert, weil viele Enzyme mit speziellen Substrat- und Regiospezifitäten noch nicht entdeckt, isoliert, verfügbar oder gar nicht existent sind. Eine Lösung des Problems ist die Anpassung der vorhandenen, bereits genutzten Enzyme an die Anforderungen der geplanten Biokatalyse. Ein solches rationales Re-Design ist den Wissenschaftler/innen des IPB jüngst für eine Catechol-O-Methyltransferase aus der Eispflanze (Mesembryanthemum crystallinum) gelungen. Das Enzym katalysiert die Methylierung verschiedener Flavonoidverbindungen, wobei die Anlagerung des Methylrestes jeweils ausschließlich am Hydroxylrest des 3. C-Atoms der Catecholgruppe, also an der Metaposition erfolgt. Im Ergebnis dieser strengen 3‘-selektiven Regiospezifität entsteht ein Vanilloid-Motiv am Flavonmolekül. Durch ortsgerichtete Mutagenese tauschten die Hallenser Wissenschaftler in der Substrattasche des Enzyms mehrere Aminosäuren aus und erhielten so neue Enzymvarianten mit entgegengesetzter, also mit 4′-Para-Regioselektivität oder mit verbesserter katalytischer Effizienz. Die 4‘-selektiven Methyltransferasen erzeugten demnach ein Isovanilloid-Motiv am Grundstamm der Flavonoidverbindungen.
Diese Änderung der Regiospezifität und damit des Methylierungsmusters am Substrat führt natürlich zu unterschiedlichen Endprodukten, wie die Hallenser Wissenschaftler am konkreten Beispiel von Eriodictyol zeigten. So entsteht bei der Methylierung von Eriodictyol am 3‘-Hydroxyl die Verbindung Homoeriodictyol, ein bitter-maskierendes Flavonon, das aus Eriodictyon californicum, dem amerikanischen Santakraut bekannt ist. Wird Eriodictyol hingegen am 4‘-Hydroxyl methyliert führt dies zur Bildung von Hesperetin, ein natürlicher Süßstoff, der in Orangenschalen vorkommt. Hesperetin hemmt als starkes Antioxidans die Lipidperoxidation und wirkt neuroprotektiv. Die neuen Enzymvarianten wurden zudem an anderen Flavonoidsubstraten erfolgreich getestet.
Generell gilt die chemo- und regioselektive O-Methylierung von Catechol-Einheiten in komplexen Molekülen als wichtiges Ziel bei der Synthese bioaktiver Verbindungen. Die Produktion der methylierten Naturstoffe auf enzymatischem Weg, ohne Schutz- und Deprotektionsstrategien und ohne toxische Lösungsmittel, sondern nur in Wasser, ist eine Möglichkeit der grünen Chemie, dieses Ziel zu erreichen. Und maßgeschneiderte Enzyme als optimale Werkzeuge zur biokatalytischen Produktion von Natur- und Wirkstoffen mit definiertem Methylierungsmuster werden dafür unerlässlich sein. Denn die künftigen biokatalytischen Synthesen von Flavonoiden, Indolen, Benzylisochinolinen und Methylestern als Ausgangsprodukte für Duftstoffe und Medikamente sind von der Verfügbarkeit an Methyltransferasen mit geeigneten Substratselektivitäten sowie Produkt- und Regiospezifitäten abhängig.