Spannende neue Enzyme und Reaktionen
Da die gerichtete Evolution mehrere Zyklen und die Expression Tausender verschiedener Mutanten erfordert, stützen sich die meisten Protein-Engineering-Kampagnen auf E. coli als einfachen Expressionswirt. Diese Konzentration auf einen prokaryotischen Wirt schränkt jedoch die Vielfalt der Enzyme ein. Mehrere von Tieren, Pflanzen und Pilzen stammende Enzyme sind posttranslational modifiziert und können in E. coli nicht oder kaum hergestellt werden.
Die Hefe Pichia pastoris kann posttranslationale Modifikationen durchführen und hat bewiesen, dass sie Proteine in einem industriell relevanten Maßstab sekretieren kann. Wir haben ein modulares Sekretions- und Nachweissystem entwickelt, das das Screening von großen Enzymbibliotheken in Pichia pastoris ermöglicht. Das Screening wurde mit einer spannenden C-H-aktivierenden Enzymklasse durchgeführt: den unspezifischen Peroxygenasen (UPOs). Eine Enzymklasse, die Hydroxylierungsreaktionen von nicht aktivierten sp3-hybridisierten Kohlenstoffen durchführen kann. Als wir das Projekt begannen, konnte jedoch nur eine Variante heterolog in Hefe hergestellt werden.
Modulare Sekretionstechnik in Hefe
Wir entwickelten ein Golden Gate-basiertes System, das ein schnelles Screening verschiedener Teile einer Expressions-/Sekretionskassette ermöglichte und begannen mit Saccharomyces cerevisiae als etablierterem Hefeorganismus. Diese Kassette bestand aus einem Signalpeptid, das für die Sekretion verantwortlich ist, verschiedenen UPO-Genen und einem C-terminalen Tag, der für die Proteinaufreinigung und den Nachweis mittels Split-GFP verantwortlich ist. Mit dem Golden Gate-Prinzip konnten wir den idealen C-terminalen Tag und die beste Signalpeptid/UPO-Gen-Kombination identifizieren und waren in der Lage, sieben der acht getesteten UPOs zu sekretieren (Commun. Biol. 4, 2021)! Alle entwickelten Plasmide sind bei AddGene erhältlich.
Gezielte Evolution
von Unspezifischen Peroxygenasen, UPOs
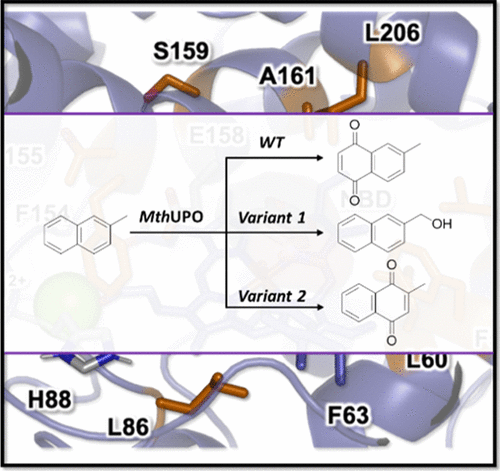
Mit dem neuen System für den Zugang und das Screening neuer UPOs haben wir die MthUPO aus einem thermophilen Pilz für die gerichtete Evolution verwendet. Ziel war es, chemodivergente Varianten zu schaffen, von denen eine an der benzylischen Position hydroxylieren kann und die andere den aromatischen Ring oxyfunktionalisiert (ACS Catal. 11, 2021). Die ersten Bibliotheken mit einzelnen Sättigungsstellen wurden mit Golden Mutagenesis erstellt. Alle Treffer wurden in einer umfangreichen Bibliothek rekombiniert. Das Screening von mehr als 5000 Transformanten führte zur Identifizierung der selektiven Varianten. Die aromatische Oxyfunktionalisierung ergibt die wichtige Verbindung Vitamin K3 (Zusammenarbeit mit Marc Garcia-Borras).
Ausweitung des Systems auf Pichia pastoris
Zur Anpassung des Systems auf P. pastoris wurde ein episomaler und integrativer P. pastoris-Vektor entwickelt. Das episomale System hat eine höhere Transformationseffizienz, eine geringere interklonale Variabilität und eine einfachere Sequenzierung, während das integrative System stabiler ist. Bei P. pastoris wurden die meisten Arbeiten unter Verwendung genomischer Integrationskonzepte durchgeführt. Beide Systeme wurden getestet, was zur erfolgreichen Sekretion einer Reihe von UPOs unter Verwendung von zwei verschiedenen Promotoren führte.
UPO-Umwandlung im präparativen Maßstab
Das neue P. pastoris-System führte zu verbesserten Produktionstitern mehrerer UPOs. Mit diesen Titern konnten ausreichende Mengen des Enzyms isoliert werden, um eine präparative Umwandlung wichtiger Phenethylaminderivate durchzuführen und das enantioselektiv hydroxylierte Produkt zu isolieren (Commun. Biol. 4, 2021).
Promotorenscreening in Pichia pastoris
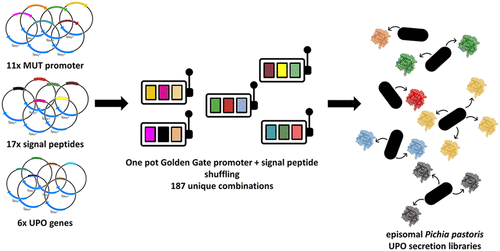
Das zuvor entwickelte episomale Expressionssystem in P. pastoris hat den Vorteil, dass große Bibliotheken gescreent werden können. Wir haben festgestellt, dass die Kombination von Promotor und Signalpeptid einen enormen und nicht vorhersehbaren Einfluss hat. Wir erweiterten das dreiteilige System um ein viertes Modul: Promotoren. 11 verschiedene Promotoren aus P. pastoris und Hansenula polymorpha wurden in Kombination mit den 17 verschiedenen Signalpeptiden untersucht. Das Screening ergab in mehreren Fällen eine deutlich verbesserte Sekretion von UPOs, Lipasen und Laccasen. Auch die Sekretion von drei weiteren UPOs wurde erstmals in Hefe beschrieben (ACS Synth. Biol. 10, 2021). Alle entwickelten Plasmide sind bei AddGene erhältlich.
Diese Seite wurde zuletzt am 21 Sep 2016 30 Sep 2021 30 Sep 2021 30 Sep 2021 30 Sep 2021 30 Sep 2021 30 Sep 2021 geändert.