Lokale Phosphat-Perzeption
Wir verwenden komplementäre experimentelle Ansätze, um die molekularen Mechanismen der pflanzlichen Antwort auf Mangel an Phosphat (Pi) und insbesondere der lokalen Pi-Perzeption von Wurzeln im Modellsystem Arabidopsis thaliana aufzuklären. Diese erstrecken sich von genetischen Screens bis zur funktionalen Analyse der involvierten Gene, Proteine und regulatorischen Netzwerke. Hierbei kommen Methoden der klassischen und molekularen Genetik, Biochemie, Strukturbiologie, Multi-Omics Technologien, Bioinformatik sowie Zellbiologie zum Einsatz. Unsere Untersuchungen von PDR (PHOSPHATE DEFICIENCY RESPONSE), LPR (LOW PHOSPHATE ROOT) und PDR SUPPRESSOR Genen ermöglichte erste Modelle und Einblicke in die lokale Pi-Perzeption im Kontext antagonistischer Wechselwirkungen zwischen Pi und assoziierten Metallkationen.
Phosphat – Metall Interaktionen
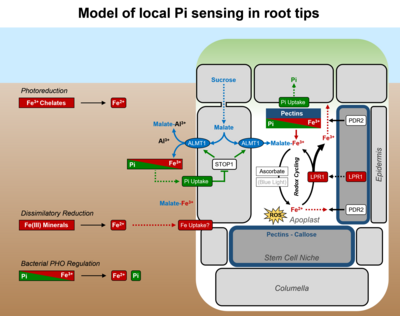
Die für Pi-Mangel typische Verkürzung der Primärwurzel erfolgt durch eine schnelle Verminderung der Zellelongation (<2 h) in der Transitionszone, gefolgt von einer Hemmung der Zellteilung (<2 d) im Wurzelmeristem. Hierbei ist die Wechselwirkung von Pi mit Eisen ausschlaggebend für die lokalen Pi-Perzeption (s. Abel 2017).
Zwei funktionell interagierende Gene spielen eine zentrale Rolle für die Pi-Perzeption der Wurzelspitze. PDR2 kodiert die solitäre, ER-lokalisierte P5-Typ ATPase, ATP5A, welche für die ER-Stressantwort (Ticconi et al. 2009) und ER-Stress-abhängige Autophagie (Naumannn et al. 2019) von Bedeutung ist. Genetische Untersuchungen (Epistasie) lassen darauf schließen, dass PDR2 entweder die Sekretion der im Apoplasten lokalisierten LPR1 Ferroxidase oder die Verfügbarkeit von LPR1 Reaktanten (Fe2+ / Fe3+) beeinflusst. Bei Pi-Mangel bestimmt die LPR1 Expressionsdomäne die zelltyp-spezifische Fe-Akkumulation in Zellwänden der Wurzelspitze, insbesondere in der Stammzellniche des Meristems (Müller et al. 2015). LPR1 definiert eine bisher unbekannte Kohorte von Fe-oxidierenden Multikupferoxidasen (MCOs) bakteriellen Ursprungs und wird über die Substratverfügbarkeit (Fe2+) reguliert wird (Naumann et al. 2022). Ein pdr2 Suppressor-Screen identifizierte zusätzliche lpr1 Mutationen, welche eine funktionelle Interaktion beider Gen-Loci unabhängig bestätigen, sowie zwei neue Gene: ALMT1 (ALUMINUM ACTIVATED MALATE TRANSPORTER 1) und STOP1 (SENSITIVE TO PROTON RHIZOTOXICITY 1). Diese interagieren, um die Exsudation von Malat in die Rhizosphere und in den Apoplasten unter Pi-Mangelbedingungen zu aktivieren. ALMT1 ist ein direktes Zielgen des Transkriptionsfaktors STOP1 und kodiert einen Malat-Kanal, der für die Al-Detoxifizierung von zentraler Bedeutung ist. Die chemische Komplementation (Applikation von Malat) des almt1 Wurzelphänotyps unter Pi-Mangel lässt auf komplexe Pi-Al Wechselwirkungen und auf eine wichtige Rolle der Chelatierung von Eisen- und Aluminiumkationen in der lokalen Pi-Perzeption schließen (Balzergue et al. 2017). Antagonistische Pi-Fe Interaktionen im Apoplasten beeinflussen nachfolgend LPR1-abhängige Fe-Redoxzyklen, Bildung von ROS, Ablagerung von Callose und somit die symplastische Kommunikation über Plasmodesmata. Diese sequenziellen Prozesse regulieren sehr wahrscheinlich die Zellelongation und Zellteilung in Wurzelspitzen in Abhängigkeit von der externen Pi-Verfügbarkeit (Müller et al. 2015, Naumann et al. 2022).
Weitere Untersuchungen an Mutanten zeigten, dass PDR2/ATP5A die Expression zellwand-modifizierender Enzyme, die Bildung und Einlagerung von Pektinen und das Muster exsudierter Verbindungen (z.B. Coumarine, Oligolignole) beeinflusst. Diese Beobachtungen unterstützen eine Funktion von PDR2 für sekretorische Prozesse, Zellwandmodifizierungen oder externe Fe-Mobilisierung (Hoehenwarter et al. 2016, Ziegler et al. 2016, Ziegler et al. 2017, Chutia et al. 2019).
Die funktionellen PDR2-LPR1 und STOP1-ALMT1 Module bilden einen ausgezeichneten Ausgangspunkt für die weitere Erforschung der lokalen Pi-Perzeption, die wir in folgende Richtungen vorantreiben:
- Biochemische Funktion und Regulation von LPR1-Typ Ferroxidasen
- Regulation der Fe-Redoxzyklen im Apoplasten
- Pi/Fe-abhängiges Redox-Signaling in der lokalen Pi Antwort
- Wechselwirkungen zwischen Pi-Mangel und assoziierten Metalltoxizitäten (Al, Fe)
Evolution der lokalen Phosphatperzeption in Landpflanzen
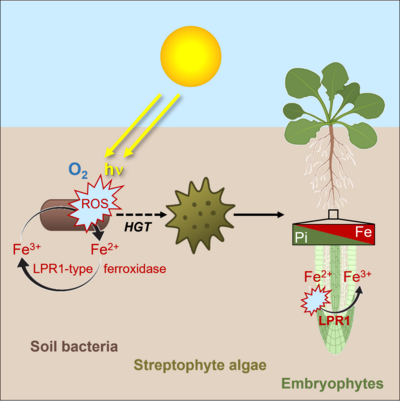
Interessanterweise erwarben Vorfahren der Streptophyten (Charophyten-Algen und Embryophyten) die MCO-Ferroxidase vom LPR1-Typ durch horizontalen Gentransfer (HGT) von terrestrischen Bakterien (Naumann et al. 2022, Abel und Naumann 2024). Somit bieten MCOs vom LPR1-Typ ein ideales System, um die Auswirkungen von HGT auf die Evolution der Landpflanzen und ihre Anpassungen an die geochemischen Gegebenheiten terrestrischer Habitate zu untersuchen. Hierbei erforschen wir die biochemische Evolution der LPR1-ähnlichen Ferroxidasen aus Bodenbakterien, Moosen, Farnen und vaskulären Pflanzen hinsichtlich ihrer enzymatischen Aktivität, Substratspezifität und Enzymkinetik. Ein weiteres Ziel ist es zu bestimmen, ob die Entwicklung der Fe-abhängigen Pi-Perzeption während der Evolution von Landpflanzen -anhand des Lebermooses Marchantia polymorpha - durch MCO-Ferroxidase vom LPR1-Typ begünstigt wurde. Im Rahmen des DFG-Schwerpunktprogramms 2237 (MAdLand - Molecular Adaptation to Land: plant evolution to change) untersuchen wir die Entwicklung der Spezifität und Selektivität von LPR1-ähnlichen Enzymen und den Einfluss von HGT auf die Evolution der frühen lokalen Pi-Perzeption, als Pflanzen mit dramatisch unterschiedlichen geochemischen Bedingungen konfrontiert waren. In dem neu eingerichteten SFB 1664 (Plant Proteoform Diversity: Bridging the gap from genetic to phenotypic variation) in Zusammenarbeit mit der MLU wollen wir direkte LPR1-Interaktoren (z. B. Fe-Transporter) identifizieren und die enzymatischen Eigenschaften im Zusammenhang mit ökotypspezifischen LPR1-Proteoformen bestimmen, welche durch Single-Nucleotide Polymorphismen entstanden sind.
P5A-type ATPase in Pflanzen – Kuratoren der ER-Qualitätskontrolle
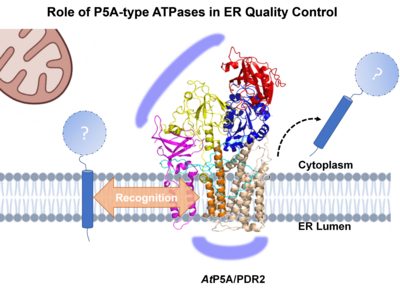
Während die LPR1 Ferroxidaseaktivität eine Schlüsselrolle in der lokalen Pi-Perzeption spielt, wird die biologische Funktion von LPR1 durch PDR2 über noch unbekannte Prozesse eingeschränkt, welche die Fe-Homöostase in der Wurzelspitze beeinflussen. Kürzlich veröffentlichte biochemische und genetische Studien zu PDR2/AtP5A-Orthologen in Hefe (Spf1p), Nematoden (CATP-8) und menschlichen Zelllinien (ATP13A1) deuten auf eine zentrale Rolle von P5A-ATPasen als Transmembranhelix-Dislokasen hin, welche fehllokalisierte bzw. falsch inserierte Proteine aus der ER-Membran umgehend extrahieren und so einen Neuanlauf für eine korrekte Proteinlokalisierung ermöglichen bzw. einen vorzeitigen und unnötigen Proteinabbau vermeiden. Daher fungieren P5A-ATPasen in der ER-Qualitätskontrolle an vorderster Front, um die Effizienz der Topogenese ER-lokalisierter und auch sekretorischer Proteine zu optimieren. Das Spektrum der P5A-Substrate und regulatorischer Interaktoren in der lokalen ER-Umgebung sowie die molekularen Erkennungsmechanismen sind bisher unbekannt. Im Gegensatz zu den schwerwiegenden, oft letalen Erkrankungen bei Säugetieren führt der P5A-Verlust in Arabidopsis (PDR2) zu weniger gravierenden, jedoch konditionell Pi-abhängigen und organspezifischen Defekten, was ein ideales experimentelles System zur Untersuchung der Funktion von P5A-ATPasen darstellt. Dementsprechend induziert die Pi-Limitierung auch die ER-Stress-vermittelte Autophagie als einen nachgeschalteten, terminalen Prozess der ER-Qualitätskontrolle (Naumann et al. 2019, Stephanie et al. 2020, Picchianti et al. 2023) über das PDR2-LPR1-Modul. Dies deutet auf eine direkte Verbindung zwischen der ER-Protein-Homöostase und der Anpassung der Wurzelentwicklung an die Pi-Verfügbarkeit hin. Im Mittelpunkt unserer Forschung stehen Untersuchungen zur:
• Zellbiologische Funktion von PDR2/AtP5A in der Pi-abhängigen Fe-Homöostase
• Mechanistischen Wirkungsweise von PDR2/AtP5A in der ER-Qualitätskontrolle
• Rolle von PDR2/AtP5A an Kontaktpunkten unterschiedlicher Zellmembranen
• Regulation der biochemischen AtP5A/PDR2 Funktion
• Funktion der ER-Stress-abhängigen Autophagie in der lokale Pi-Perzeption
Diese Seite wurde zuletzt am 26 Jan 2016 25 Apr 2025 25 Apr 2025 25 Apr 2025 25 Apr 2025 geändert.