Chemische Diversität auf der Blattoberfläche
Der erste Kontakt von Blattpathogenen mit ihren (potentiellen) Wirten findet auf der Blattoberfläche statt. Hier tragen spezialisierte Metaboliten zu der Entscheidung bei, ob das Pathogen die Pflanze befallen kann oder ob die Pflanze dies erfolgreich verhindern kann. Die chemische Zusammensetzung auf der Blattoberfläche wird von Metaboliten und Enzymen der Pflanze und des Pathogens bestimmt und ist für die chemische Kommunikation der Partner von Bedeutung.
Unsere Arbeiten konzentrieren sich auf zwei Schwerpunkte:
- Wie werden Pflanzenmetaboliten synthetisiert und auf die Blattoberfläche transportiert?
- Wie tragen die Metaboliten zur Pathogenabwehr bei?
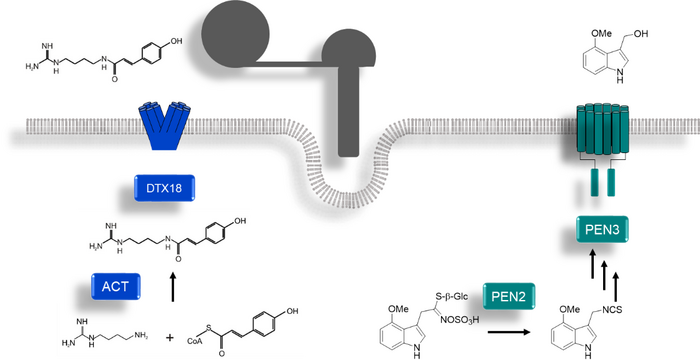
Abb. 1: Chemische Abwehr von Arabidopsis gegen P. infestans. Nach versuchter Penetration synthetisieren und exportieren Arabidopsis-Pflanzen phenolische und indolische Substanzen an der Infektionsstelle. Modell nach Lipka et al., 2005, Stein et al., 2006, Bednarek et al., 2009, Dobritzsch et al., 2016 and Matern et al., 2019.
Um Substanzen zu identifizieren, die auf der Blattoberfläche akkumulieren, führen wir ungerichtete Metabolitenanalysen mittels UPLC-ESI-QTOF-MS durch. Die Strukturen der Moleküle, die präferentiell nach Inokulation mit P. infestans auf der Blattoberfläche vorhanden sind, werden durch Tandem-MS und bioinformatische Ansätze der Arbeitsgruppe von Steffen Neumann aufgeklärt. Die funktionelle Charakterisierung von ausgewählten Metaboliten umfasst die Analyse der Wachstums- und Sporenkeimungs-Inhibierung eines GFP-exprimierenden P. infestans-Isolats (freundlicherweise von Felix Mauch, Universität Fribourg, Schweiz, zur Verfügung gestellt; Eschen-Lippold et al., 2009).
Wir konnten auf diese Weise einen MATE-Transporter aus Arabidopsis identifizieren, der für den Export spezifischer, Sporenkeimungs-inhibierender Hydroxyzimtsäure-Amide (HCAA) verantwortlich ist (Abb. 2). Der Transfer zweier Gene für die Biosynthese (ACT) und den Transport (DTX18) aus Arabidopsis in Kartoffelpflanzen führt zu hohen Mengen an HCAA auf der Blattoberfläche. Dies korreliert mit einer erhöhten Abwehr gegen Infektionen mit P. infestans, was die Bedeutung von antimikrobiellen Oberflächenmetaboliten für die erfolgreiche Pathogenabwehr zeigt (Dobritzsch et al., 2016).
Der ABC-Transporter PEN3, der für die Penetrationsresistenz von Arabidopsis gegen P. infestans notwendig ist (Stein et al., 2006), transportiert Produkte des Enzyms PEN2 in den Apoplasten. Wir identifizierten eine Substanz, die PEN2-abhängig synthetisiert und in vitro PEN3-abhängig transportiert wird (Zusammenarbeit mit Bernhard Westermann, IPB und Markus Geisler, Universität Fribourg, Schweiz). Diese Substanz wirkt jedoch nicht antimikrobiell, sondern verstärkt flg22-induzierte Kalloseablagerung in Arabidopsis-Keimlingen (Matern et al., 2019). In einem DFG-geförderten Projekt untersuchen wir zurzeit Oberflächenmetaboliten auf Blättern von Wildformen der Kartoffel, die resistent gegen P. infestans sind.
PAMP-vermittelte Abwehr in Kartoffel
Die Kartoffel (Solanum tuberosum L.) ist eine Wirtspflanze für P. infestans. Interessanterweise kann die anfällige Kartoffelsorte Désirée durch die Behandlung mit dem Oligopeptid Pep-13, einem Pathogen-assoziierten Muster („pathogen associated molecular pattern“, PAMP) aus Phytophthora, eine Infektion abwehren (Brunner et al., 2002). Die Erkennung von Pep-13 führt zur Aktivierung einer starken, lokalen Abwehrantwort, die durch die Akkumulation von Salicylsäure, Jasmonsäure und Wasserstoffperoxid, sowie einem lokalen, hypersensitiven Zelltod charakterisiert ist (Halim et al., 2004; Halim et al., 2009; Abb. 2). Wenn Pep-13-behandelte Pflanzen anschließend mit P. infestans inokuliert werden, sind Krankheitssymptome und Pathogenbiomasse reduziert. Um die Mechanismen dieser induzierten Resistenz zu verstehen, wurden durch Microarray-Analysen und RNA-Sequenzierung Gene identifiziert, die durch Pep-13-Behandlung aktiviert werden. Ausgewählte Kandidatengene werden funktionell analysiert, indem in transgenen Pflanzen ihre Expression herabgesetzt wird.
Für die Perzeption von Pep-13 wird eine plasmamebranständige Rezeptorkinase („receptor-like kinase“, RLK) postuliert. Wir zeigten, dass BAK1, ein Co-Rezeptor von RLK, für die frühen Reaktionen auf Pep13-Behandlung notwendig ist. In transgenen Pflanzen mit verringerter BAK1-Expression wird allerdings, trotz stark reduzierter Bildung von reaktiven Sauerstoffspezies und stark reduzierte MAP-Kinase-Aktivierung, die Expression von Abwehrgenen beobachtet.
Kartoffelpflanzen mit reduzierter Expression des Syntaxin-Gens StSYR1 können keine Kallose-haltigen Papillen mehr an den Infektionsstellen bilden (Eschen-Lippold et al., 2012), was auf die Bedeutung von Vesikel-Fusionsprozessen für die Zellwandverstärkung hinweist. In Zusammenarbeit mit Ingo Heilmann (MLU Halle) untersuchen wir die Rolle von Phosphoinositiden für sekretorische Prozesse während der PAMP-vermittelten Abwehr.
Unsere Untersuchungen zeigten weiterhin, dass der ABC-Transporter ABCG1 für die Bildung von Suberin in Kartoffel verantwortlich ist. Suberin ist ein lipophiles Polymer, das als Transpirationsbarriere fungiert. Transgene Pflanzen mit reduzierter ABCG-Expression können kein Suberin mehr in der Knollenschale bilden, was zu einem defekten Periderm und erhöhtem Wasserverlust führt. Metaboliten-Analysen zeigten massive Veränderungen in der Suberin-Zusammensetzung, sowie die Akkumulation von Suberinvorstufen, was auf eine Rolle des Transporters beim Export von Suberinmonomeren hinweist (Landgraf et al., 2014). Im Rahmen des Graduiertenprogramms „Agripoly“ (MLU Halle, Hochschule Anhalt) untersuchen wir zurzeit die Rolle von Suberin für die Pathogenantwort mittels CRISPR-Cas9-editierter Kartoffelpflanzen.
Referenzen:
- Bednarek P, Pislewska-Bednarek M, Svatos A, Schneider B, Doubsky J, Mansurova M, Humphry M, Consonni C, Panstruga R, Sanchez-Vallet A, Molina A, and Schulze-Lefert P. (2009). A glucosinolate metabolism pathway in living plant cells mediates broad-spectrum antifungal defense. Science 323, 101-106.
- Brunner F, Rosahl S, Lee J, Rudd JJ, Geiler C, Kauppinen S, Rasmussen G, Scheel D, and Nürnberger T. (2002). Pep-13, a plant defense-inducing pathogen-associated pattern from Phytophthora transglutaminases. EMBO J 21, 6681-6688.
- Dobritzsch M, Lübken T, Eschen-Lippold L, Gorzolka K, Blum E, Matern A, Marillonnet S, Böttcher C, Dräger B, and Rosahl S. (2016). MATE transporter-dependent export of hydroxycinnamic acid amides. Plant Cell 28, 583-596.
- Eschen-Lippold L, Draeger T, Teichert A, Wessjohann L, Westermann B, Rosahl S, and Arnold N. (2009). Anti-oomycete activity of γ-oxocrotonate fatty acids against P. infestans. J Agric Food Chem 57, 9607-9612.
- Eschen-Lippold L, Landgraf R, Smolka U, Schulze S, Heilmann M, Heilmann I, Hause G, and Rosahl S. (2012). Activation of defense against Phytophthora infestans in potato by down-regulation of syntaxin gene expression. New Phytol 193, 985-996.
- Halim VA, Hunger A, Macioszek V, Landgraf P, Nürnberger T, Scheel D, and Rosahl S. (2004). The oligopeptide elicitor Pep-13 induces salicylic acid-dependent and-independent defense reactions in potato. Physiol Mol Plant Pathol 64, 311-318.
- Halim VA, Altmann S, Ellinger D, Eschen-Lippold L, Miersch O, Scheel D, and Rosahl S. (2009). PAMP-induced defense responses in potato require both salicylic acid and jasmonic acid. Plant J 57, 230-242.
- Landgraf R, Smolka U, Altmann S, Eschen-Lippold L, Senning M, Sonnewald S, Weigel B, Frolova N, Strehmel N, Hause G, Scheel D, Böttcher C, and Rosahl S. (2014). The ABC transporter ABCG1 is required for suberin formation in potato tuber periderm. Plant Cell 26, 3403-3415.
- Lipka V, Dittgen J, Bednarek P, Bhat R, Wiermer M, Stein M, Landtag J, Brandt W, Rosahl S, Scheel D, Llorente F, Molina A, Parker J, Somerville S, and Schulze-Lefert P. (2005). Pre- and postinvasion defenses both contribute to nonhost resistance in Arabidopsis. Science 310, 1180-1183.
- Matern A, Böttcher C, Eschen-Lippold L, Westermann B, Smolka U, Döll S, Trempel F, Aryal B, Scheel D, Geisler M, and Rosahl S. (2019). A substrate of the ABC transporter PEN3 stimulates bacterial flagellin (flg22)-induced callose deposition in Arabidopsis thaliana. J Biol Chem 294, 6857-6870.
- Stein M, Dittgen J, Sanchez-Rodriguez C, Hou BH, Molina A, Schulze-Lefert P, Lipka V, and Somerville S. (2006). Arabidopsis PEN3/PDR8, an ATP binding cassette transporter, contributes to nonhost resistance to inappropriate pathogens that enter by direct penetration. Plant Cell 18, 731-746.
Diese Seite wurde zuletzt am 10 Feb 2017 12 Nov 2019 12 Nov 2019 12 Nov 2019 12 Nov 2019 12 Nov 2019 12 Nov 2019 geändert.


