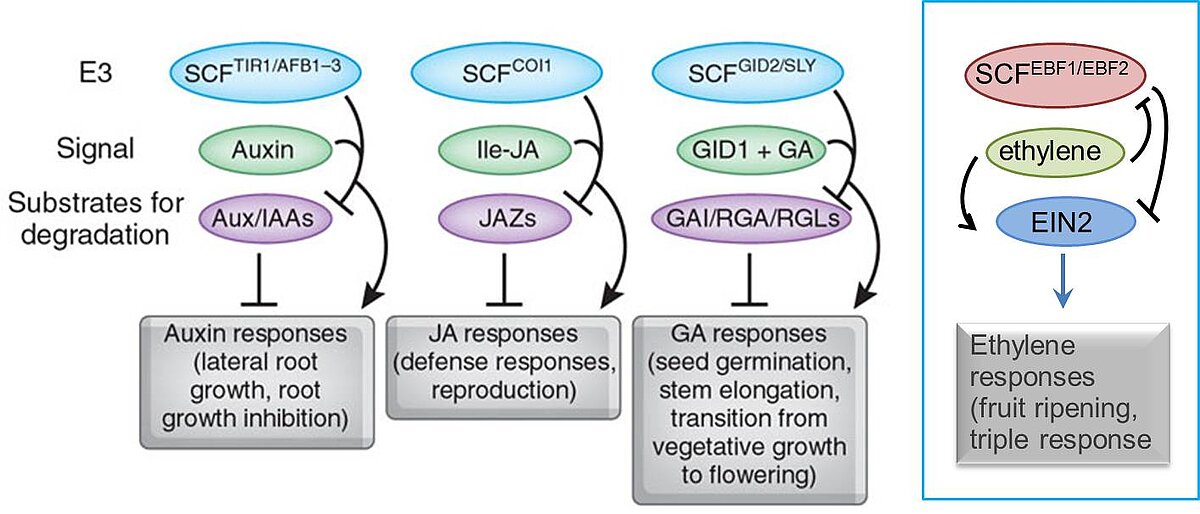
Um ein Protein selektiv abzubauen, wird in eukaryotischen Zellen das Substrat über eine Enzymkaskade mit einer Polyubiquitinkette versehen, welches als Markierung für den proteasomalen Abbau dient. In E3-Komplexen vom SKP1/CDC53/F-Box-Protein (SCF)-Typ ist das F-Box-Protein (FBP) dabei von zentraler Bedeutung. Es verleiht dem E3-Komplex Spezifität durch direkte Interaktion mit dem abzubauenden Zielprotein (Abb. 1).
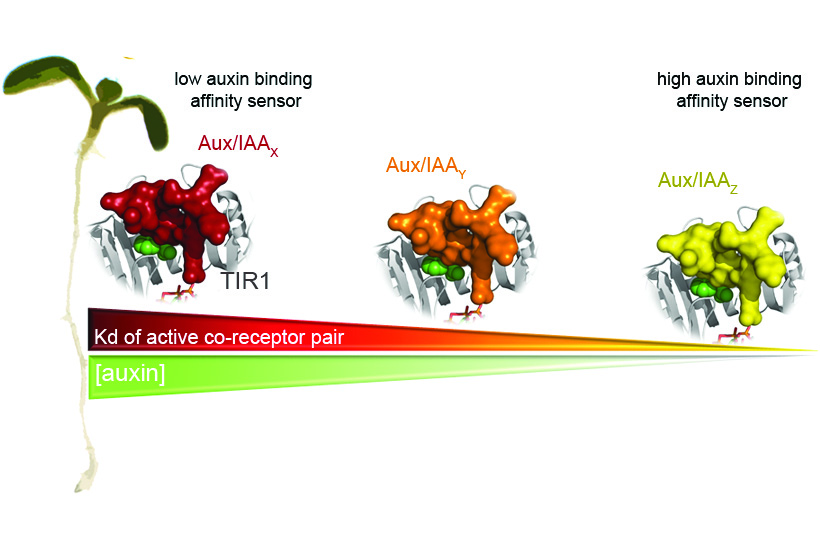
Die Auxinantwort beruht auf dem zielgerichteten Abbau von reprimierenden AUX/IAA-Transkriptionsfaktoren durch eine kernlokalisierte E3-Ligase, SCFTIR1/AFB. SCFTIR1/AFB dient zusammen mit den AUX/IAA-Zielproteinen als Ko-Rezeptor für die Auxinperzeption, wobei spezifische TIR1/AFB-AUX/IAA-Ko-Rezeptorpaare unterschiedlich "empfindlich" für Auxin sind und diverse "Auxin-Sensoren" in vivo bilden (Abb. 2).
Dieser Kleinmolekül-Sensor ist ein überaus simples und dennoch geschicktes System aus einem Leucine-rich-repeat (LRR) -F-Box-Protein (FBP), dem Zielprotein für den Ubiquitin-vermittelten Abbau, sowie einem Phosphoinositid. Die Aufklärung des TIR1-AUX/IAA-Modells war ein Durchbruch in jeder Hinsicht: Zum einen lieferte es die Antwort auf die lange gestellte Frage nach dem Auxinrezeptor. Zum anderen konnte erstmals gezeigt werden, dass ein SCFTIR1/AFB und sein Zielprotein direkt einen niedermolekularen Liganden – in diesem Fall Auxin – binden. Die Gruppe Signalintegration geht diesen zentralen Erkenntnissen weiter nach und führt Struktur-Funktionsanalysen am TIR1-Auxin-AUX/IAA-System durch. Weiterhin forschen wir an den Mechanismen zur niedermolekularen Naturstoff-E3-Ligasen-Bindung bei Pflanzen (Abb. 3).
Diese Seite wurde zuletzt am 06 Jun 2012 10 Dec 2024 13 Feb 2020 13 Feb 2020 13 Feb 2020 27 Jul 2016 13 Feb 2020 27 Jul 2016 geändert.